El hidrógeno es una opción atractiva como combustible porque no
emite dióxido de carbono. Muchos intentos de producir hidrógeno gaseoso parten
de agua dulce o desalinizada, pero estos métodos pueden ser caros y requerir
mucha energía. El agua de mar es una mezcla compleja de hidrógeno, oxígeno,
sodio y otros elementos, lo que dificulta la extracción de hidrógeno gaseoso
para usos energéticos limpios.
Ahora, los investigadores han encontrado una forma de extraer
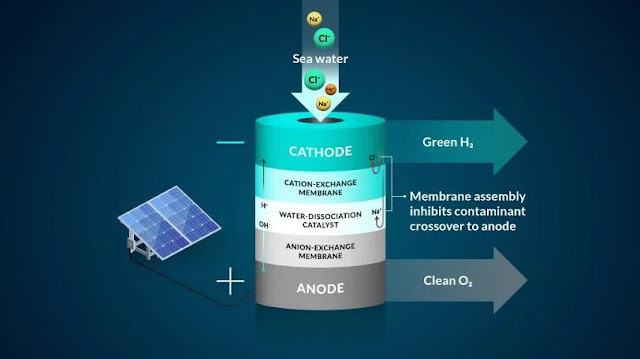
hidrógeno del océano canalizando el agua de mar a través de un sistema de doble
membrana y electricidad.
Desarrollado
por investigadores del Laboratorio Nacional de Aceleradores SLAC del Departamento
de Energía y la Universidad de Stanford, con colaboradores de la Universidad de
Oregón y la Universidad Metropolitana de Manchester, el
innovador diseño consiguió generar gas hidrógeno sin producir grandes
cantidades de subproductos nocivos.
El
equipo implementó un sistema de membrana bipolar,
o de dos capas, y lo probó mediante electrólisis, un método que utiliza la
electricidad para impulsar iones, o elementos cargados, para ejecutar una
reacción deseada. Empezaron su diseño controlando el cloruro, el elemento más
dañino para el sistema de agua de mar.
Hay muchas especies reactivas en el agua
de mar que pueden interferir en la reacción agua-hidrógeno, y el cloruro sódico
que hace salada el agua de mar es uno de los principales culpables. En
concreto, el cloruro que llega al ánodo y se oxida reducirá la vida útil de un
sistema de electrólisis y puede llegar a ser inseguro debido a la naturaleza
tóxica de los productos de oxidación que incluyen cloro molecular y lejía.
Joseph
Perryman, investigador postdoctoral de SLAC y Stanford.
La membrana bipolar del experimento
permite acceder a las condiciones necesarias para producir gas hidrógeno y
evita que el cloruro llegue al centro de reacción.
En sus experimentos, los protones, los
iones de hidrógeno positivos, atravesaban una de las capas de la membrana hasta
un lugar donde podían ser recogidos y convertidos en gas hidrógeno al
interactuar con el cátodo, un electrodo cargado negativamente. La segunda
membrana del sistema sólo permitía el paso de iones negativos, como el cloruro.
Como protección adicional, una capa de
la membrana contenía grupos cargados negativamente que estaban fijados a la
membrana. Según los investigadores, esto dificultaba que otros iones cargados
negativamente, como el cloruro, se desplazaran a lugares donde no debían estar.
La membrana cargada negativamente resultó ser muy eficaz para bloquear casi
todos los iones de cloruro en los experimentos del equipo. Además, su sistema
funcionaba sin generar subproductos tóxicos como lejía y cloro.
También existe cierto interés en
utilizar la electrólisis para producir oxígeno. Comprender el flujo y la
conversión de iones en nuestro sistema de membrana bipolar también es
fundamental para este esfuerzo. Además de producir hidrógeno en nuestro
experimento, también demostramos cómo utilizar la membrana bipolar para generar
oxígeno gaseoso.
Daniela
Marin, estudiante de postgrado de ingeniería química en Stanford y coautora del
estudio.
En futuros trabajos, los
investigadores planean mejorar sus electrodos y membranas construyéndolos con
materiales más abundantes y fáciles de extraer. Según el equipo, esta
mejora del diseño podría facilitar la ampliación del sistema de electrólisis al
tamaño necesario para generar hidrógeno destinado a actividades que consumen
mucha energía, como el sector del transporte.
El futuro de las tecnologías verdes del
hidrógeno es brillante. Los conocimientos fundamentales que estamos obteniendo
son clave para informar futuras innovaciones para mejorar el rendimiento, la
durabilidad y la escalabilidad de esta tecnología.
FUENTE: Thomas Jaramillo, profesor de SLAC y
Stanford y director de SUNCAT.
No hay comentarios:
Publicar un comentario